0 引言
目前能对工程材料进行去除加工的手段多种多样,大体上可以分为传统机械加工方法和特种加工方法。传统的机械加工是通过刀具、磨具等直接利用机械能去除多余材料的方法,如车削加工、铣削加工、刨削加工和磨削加工等。特种加工是利用电能、热能、声能、光能、化学能和电化学能等对工件材料进行去除的方法,如电火花加工、电子束加工、离子束加工、超声波加工、激光加工、化学蚀刻加工、机械化学加工、电化学加工等。上述所有的加工方法均采用物理或化学的形式进行加工。
生物加工方法是继物理和化学形式之后出现的另外一种加工形式——生物形式。目前国际上关于生物加工方法研究方面已经有了一些进展,出现了生物去除加工(biomachining)、生物沉积加工(biodeposition)、生物成形加工(bioforming)等加工方法[1-3]。其中,生物去除加工以其独特的加工方式和绿色无污染的优点,在制造业内尤其受到重视。作为生物制造的一个重要组成部分,生物去除加工正逐渐发展起来,特别是最近20年,生物去除加工越来越受到人们的关注[4-10]。
生物去除加工是一种利用微生物作为工具去除工件材料的加工方法。在众多种类微生物的生命活动中蕴含着各种各样的材料加工机理,以获得维持其生命和繁殖所需的能量与营养物质。微生物对固体材料的作用形式有:合成生物体材料富集、浸出、材料腐蚀。生物去除加工正是通过微生物对材料的腐蚀从而实现对材料的加工。这些微生物(如氧化亚铁硫杆菌和氧化硫硫杆菌等)能够利用铜、铁、铝等金属在氧化过程中所释放出来的化学能作为自身生长所需的能量,并利用空气中的二氧化碳作为碳源,来为自身提供养分从而进行生长繁殖。
本文对生物去除加工技术产生的背景、发展概况和加工机理进行了介绍,归纳了生物去除加工的材料种类、生物去除加工所用的微生物种类和培养基种类,并对生物去除加工技术的发展方向进行了展望。
1 生物去除加工的发展
生物去除加工技术是在生物冶金技术的基础上发展起来的,这两种技术在加工过程中所用的细菌液对金属有着相同的侵蚀过程,所利用的微生物种类也是相同的。生物冶金是利用某种微生物的特殊代谢活动,使所处的溶液具备对矿石的侵蚀作用,经过侵蚀后矿物金属离子溶于溶液中,同时矿物中的化学能被用于微生物的进一步代谢,最后通过电解沉积将溶液中的金属离子还原成固态金属的一种技术。该技术具有流程短、成本低、环境友好等优点,适用于处理贫矿、废矿、表外矿及难以用传统方法进行采、选、冶的矿物[11]。
早期人们对微生物浸矿作用的认识一直处于萌芽阶段。直到1947年COLMER等[12]首次通过实验证实酸性矿坑水中含有一种能将Fe2+氧化为Fe3+的细菌,虽然不能确认细菌种类,但能证实这种细菌在金属矿的氧化和酸化过程中起着重要作用,同时,他们也分离得到了另外一种细菌,该细菌的形态、生长、生理特征与WAKSMAN等[13]在1922年分离发现的氧化硫硫杆菌十分相似(之后学者们认为该细菌是氧化亚铁硫杆菌),从此,人们开始认识到微生物对冶金的价值。1958年BRYNER等[14]较系统地研究了各种硫化物的微生物浸出,报道了氧化亚铁硫杆菌在硫化矿浸出中的作用。同年ZIMMERLEY等[15]申请获得了第一个生物冶金的专利。随后,各国学者陆续对生物冶金微生物进行了大量的研究和报道,尤其针对硫杆菌属的氧化亚铁硫杆菌和氧化硫硫杆菌的研究最为广泛。
最早对生物去除加工技术进行研究的是UNO等[1,16],他们从1996年开始对微生物去除加工金属工程材料进行研究,初步证实了细菌对纯铁、纯铜去除加工的可能性,证明了加工深度与加工时间大致成正比,此外还证明了在电场的作用下,细菌对金属的去除率会更高。从此,学术界对微生物去除加工金属材料的研究工作开始发展起来,但对生物去除加工的机理仅作了猜测,并未加工出机械零件。1997—1999年,ZHANG等[17-18]进一步证实了微生物去除加工金属材料的可行性,首次阐明了氧化亚铁硫杆菌对金属材料去除加工的机理,并在3 mm厚的纯铜片上用氧化亚铁硫杆菌生物加工出85 μm厚的齿轮零件和70 μm深、200 μm宽的5个沟槽,实现了微米级加工。自2000年开始,相继有不少学者围绕生物去除加工机理、生物刻蚀加工以及加工参数对生物去除加工形貌和材料去除率的影响等几大方面进行了研究[19-41]。
2 生物去除加工材料、常用菌种和培养基
2.1 生物去除加工材料
目前生物去除加工的对象主要为金属材料,相关文献报道主要集中在纯金属类(铜、铁、铝、镍等),也有对各种合金类(康铜、不锈钢、黄铜等)的报道。
在生物去除加工研究文献中,有一部分对不同金属材料的去除率进行了研究,证实了在相同加工参数条件下材料的去除率与材料的性质有关。ZHANG等[17]通过实验测得了纯铁、纯铜和铜镍合金的生物去除加工速度分别为10 μm/h、13.5 μm/h和13.3 μm/h。YANG等[19]通过实验测得黄铜、青铜和纯铜的生物去除加工速度分别为9.20 μm/h、10.82 μm/h和13.62 μm/h。HOCHENG等[20]利用微生物培养上清液对纯铜、纯镍、纯锌、纯铝和纯锡进行了加工,测得去除率分别为5.5 mg/(h·cm2)、4.2 mg/(h·cm2)、3.2 mg/(h·cm2)、0.7 mg/(h·cm2)和1.0 mg/(h·cm2)。从上述文献中可以发现,纯铜的生物去除加工速度是最快的,同时,关于纯铜进行生物去除加工的研究文献也最多。
生物去除加工材料、所用菌种、培养基的汇总情况如表1所示。
表1 生物去除加工材料与所用菌种、培养基
Tab.1 The biomachining materials, microorganisms,mediums and references
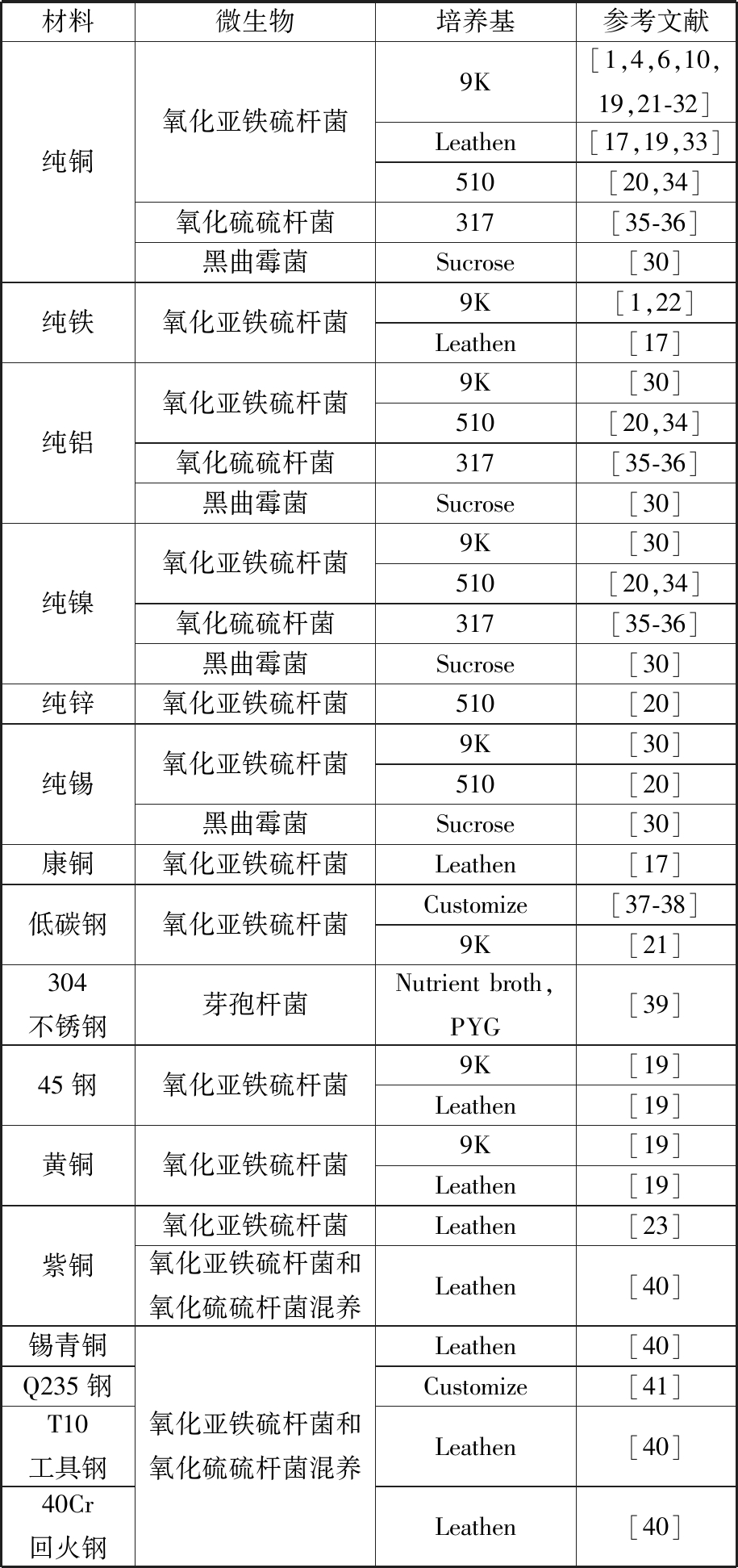
材料微生物培养基参考文献纯铜氧化亚铁硫杆菌9K[1,4,6,10,19,21-32]Leathen[17,19,33]510[20,34]氧化硫硫杆菌317[35-36]黑曲霉菌Sucrose[30]纯铁氧化亚铁硫杆菌9K[1,22]Leathen[17]纯铝氧化亚铁硫杆菌9K[30]510[20,34]氧化硫硫杆菌317[35-36]黑曲霉菌Sucrose[30]纯镍氧化亚铁硫杆菌9K[30]510[20,34]氧化硫硫杆菌317[35-36]黑曲霉菌Sucrose[30]纯锌氧化亚铁硫杆菌510[20]纯锡氧化亚铁硫杆菌9K[30]510[20]黑曲霉菌Sucrose[30]康铜氧化亚铁硫杆菌Leathen[17]低碳钢氧化亚铁硫杆菌Customize[37-38]9K[21]304不锈钢芽孢杆菌Nutrient broth,PYG[39]45钢氧化亚铁硫杆菌9K[19]Leathen[19]黄铜氧化亚铁硫杆菌9K[19]Leathen[19]紫铜氧化亚铁硫杆菌Leathen[23]氧化亚铁硫杆菌和氧化硫硫杆菌混养Leathen[40]锡青铜Q235钢T10工具钢40Cr回火钢氧化亚铁硫杆菌和氧化硫硫杆菌混养Leathen[40]Customize[41]Leathen[40]Leathen[40]
2.2 生物去除加工菌种
目前最常用的生物去除加工菌种为氧化亚铁硫杆菌,其次为氧化硫硫杆菌。
(1)氧化亚铁硫杆菌。氧化亚铁硫杆菌(Acidithiobacillus ferroxidans, A. ferroxidans)是由COLMER等[12]于1947年通过实验分离得到的。氧化亚铁硫杆菌为革兰氏阴性细菌,棒状,长1~2 μm,粗约0.5 μm,端生鞭毛,可在液体中快速移动,最适pH值为2.0~2.5。氧化亚铁硫杆菌能氧化Fe2+、单质的硫和低价位的硫化合物,同时可从反应过程中获取化学能,并通过溶解氧作为电子的受体,起到一个催化氧化的作用,因此,氧化亚铁硫杆菌自从被发现后,一直被认为是最重要的浸矿和生物去除加工微生物。
(2)氧化硫硫杆菌。氧化硫硫杆菌(Acidithiobacillus thiooxidans, A. thiooxidans)是由WAKSMAN等[13]于1922年通过实验分离得到的。氧化硫硫杆菌为革兰氏阴性细菌,体型与氧化亚铁硫杆菌相当,端生鞭毛,最适pH值为2.0~2.5。氧化硫硫杆菌能快速地将单质的硫和低价位的硫化合物氧化成高价位的硫,并在溶液中生成硫酸,从而可将溶液的pH值降到1甚至更低,因此氧化硫硫杆菌能够在很低的pH值环境下生存。但氧化硫硫杆菌不能氧化Fe2+,且早期相关文献报道不多,直到发现其与氧化亚铁硫杆菌混合培养可使生物去除加工的速率明显高于氧化亚铁硫杆菌单独培养的加工速率[41-43]后才逐渐受到关注。
2.3 培养基
2.3.1 液体培养基
目前生物去除加工所用的菌种主要来自于生物冶金领域,这些微生物都是好氧细菌。有时氧化亚铁硫杆菌和氧化硫硫杆菌可以共同培养在同一培养基中[41,44],通常在液体培养基中进行培养,在固体平板培养基上进行细菌分离,以实现菌种的分离。
液体培养基主要用来实现微生物的快速富集。为了研究某个类型纯菌种的生长、繁殖、生态、生理等特性,必须采用液体培养基进行大量富集培养。富集培养主要是针对所培养微生物或想要分离得到的微生物的生长活动特点制定的特定环境条件,使微生物在数量上快速增加。此外,从自然界中采集的混合菌群,为了分离得到单一的纯菌株,也必须对混合菌群进行富集培养。
2.3.1.1 液体培养基化学成分
这些培养基大体上由两部分物质组成:一部分提供细菌生长繁殖所必需的物质(如N、P、K、Ca、Mg、S等),这一部分主要由各种无机盐组成,含量较小,特定型号的培养基无机盐浓度为确定值,不会变化;另一部分是提供微生物生长活动所需能量来源的能源物质。由于生物去除加工所用的细菌以化能自养为主,能量来源通常以氧化某种无机物来获得:如Fe2+或还原态的硫元素的需求量往往较高,特定型号的培养基对这部分物质的浓度没有作明确的规定,可以根据实际情况和特定的实验安排配制不同的浓度(在氧化亚铁硫杆菌利用9K培养基的菌种活化过程中,配制的FeSO4浓度往往只有正常情况下的一半浓度或者更低)。
2.3.1.2 液体培养基pH值调节
特定型号的培养基对pH值没有明确规定,但主要用体积比为1∶1的H2SO4溶液进行调节,如9K、Leathen和510培养基的pH值一般调节在1.8~2.5之间。
2.3.1.3 液体培养基灭菌
在培养基灭菌方面,往往将培养基预先配制成两个部分,分别对两部分溶液采用不同的灭菌方法进行灭菌。对于不易氧化的无机盐部分,通常统一配制成一种溶液,预先调好pH值,再进行121 ℃高温高压灭菌15~30 min。对于9K培养基等培养基中容易氧化的FeSO4溶液,如果直接进行高温灭菌,Fe2+极易被氧化成Fe3+,从而导致无法为培养的微生物提供化学能而失效。因此需先调节pH值,再采用孔径比一般杂菌个体小得多的水性滤膜(如孔径为0.22 μm的滤膜)对FeSO4溶液进行过滤除菌,最后将各自完成灭菌的溶液混合成预定浓度的混合溶液。317培养基中的硫粉同样不能高温灭菌,需采用酒精灭菌法加75%(体积比)的酒精,搅拌浸泡2 h后静置,倒出液体后再加酒精,重复3次后,在紫外灯下晾干或蒸馏去除酒精。
2.3.1.4 液体培养基种类
对于前文所述的两种细菌,分别都有各自喜好的培养基,因此不同的培养基仅适用于培养特定种类的生物去除加工菌种。主要的液体培养基种类有:9K培养基、Leathen培养基、510培养基、317培养基。
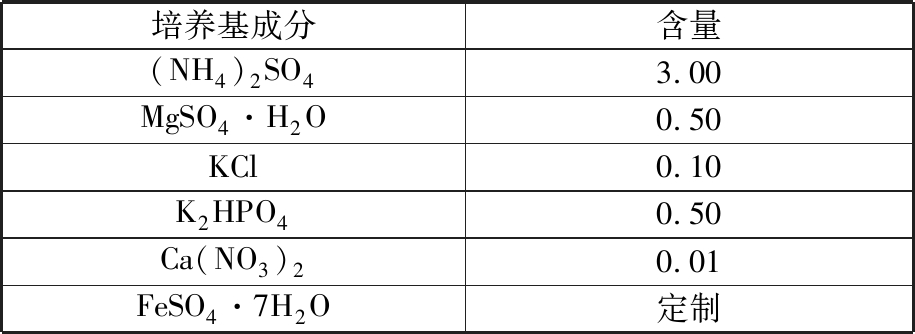
(1)9K培养基。9K培养基最早由SILVERMAN等[45]于1959年制作而成,主要用于培养氧化亚铁硫杆菌,是生物去除加工过程中应用最多的一种培养基。9K培养基的组分见表2。
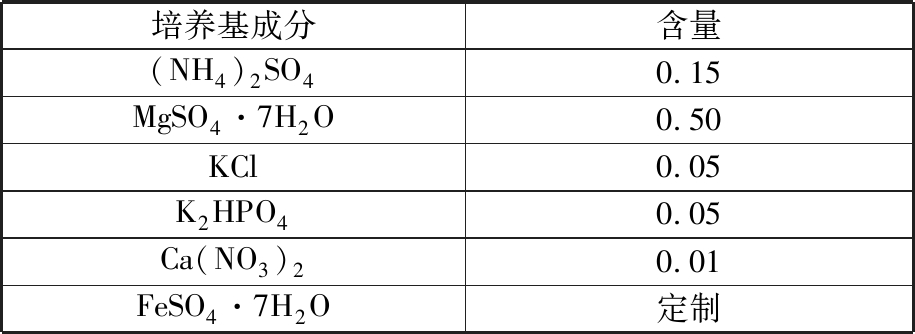
(2)Leathen培养基[17,19,33,46]。由LEATHEN等[46]于1951年制作而成,主要适用于培养氧化亚铁硫杆菌。Leathen培养基的组分见表3。
表2 9K 培养基组分
Tab.2 9K medium compositions g/L
培养基成分含量(NH4)2SO43.00MgSO4·H2O0.50KCl0.10K2HPO40.50Ca(NO3)20.01FeSO4·7H2O定制
表3 Leathen培养基组分
Tab.3 Leathen medium compositions g/L
培养基成分含量(NH4)2SO40.15MgSO4·7H2O0.50KCl0.05K2HPO40.05Ca(NO3)20.01FeSO4·7H2O定制
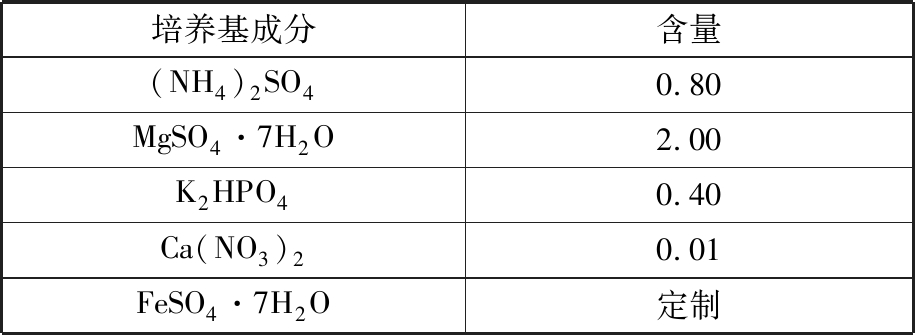
(3)510培养基[20,28]。510培养基主要由两部分组成,一部分由表4所示的基础化学成分组成,另一部分由表5所示的微量元素组成,主要用于培养氧化亚铁硫杆菌。
表4 510培养基基础化学组分
Tab.4 510 medium basic chemical compositions g/L
培养基成分含量(NH4)2SO40.80MgSO4·7H2O2.00K2HPO40.40Ca(NO3)20.01FeSO4·7H2O定制
表5 510培养基微量元素
Tab.5 510 medium compositions g/L
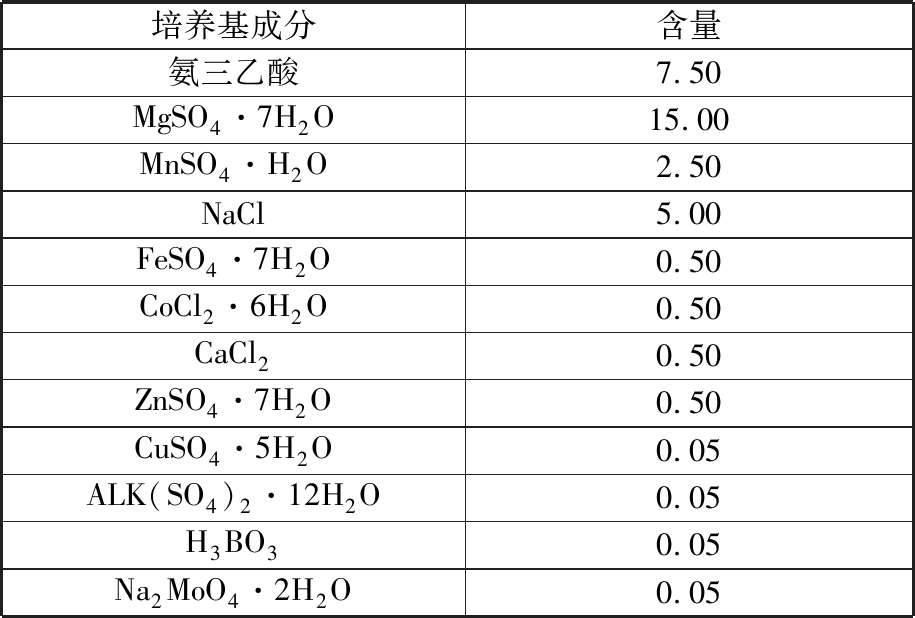
培养基成分含量氨三乙酸7.50MgSO4·7H2O15.00MnSO4·H2O2.50NaCl5.00FeSO4·7H2O0.50CoCl2·6H2O0.50CaCl20.50ZnSO4·7H2O0.50CuSO4·5H2O0.05ALK(SO4)2·12H2O0.05H3BO30.05Na2MoO4·2H2O0.05
(4)317培养基[35-36]。317培养基由表6所示的化学成分组成,主要用于培养氧化硫硫杆菌。
表6 317培养基组分
Tab.6 317 medium compositions g/L
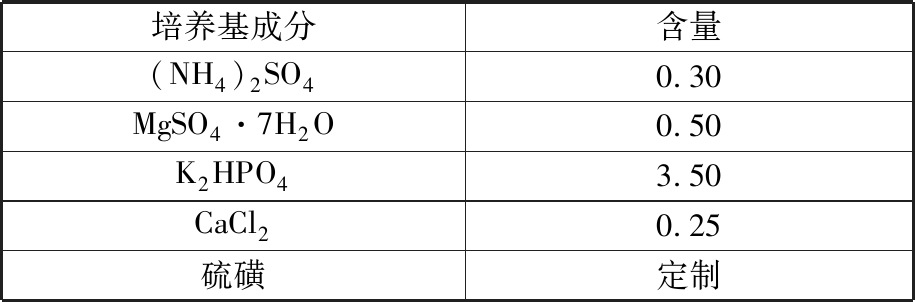
培养基成分含量(NH4)2SO40.30MgSO4·7H2O0.50K2HPO43.50CaCl20.25硫磺定制
2.3.2 固体培养基
2.3.2.1 固体培养基化学成分
固体培养基是在液体培养基化学成分的基础上添加凝固剂(如琼脂),使培养基呈固态而失去流动性,实现微生物单细胞在一个相对固定的位置生长,增殖培养形成该微生物独有的菌落形态(如菌斑)。固体培养基在微生物研究中具有非常重要的意义,菌斑通常由单个微生物菌体长成,因此可以对单个菌斑挑取继续培养来进行菌种分离,对菌斑计数统计活菌数量,观察菌斑的形态来进行菌种的初步鉴定,也可以对菌种进行短期的保藏。
2.3.2.2 固体培养基pH值调节
特定型号的培养基对pH值没有明确规定,但是固体培养基相对于液体培养基水分相对较少,凝固成平板后与空气接触面积非常大,易导致水分蒸发,从而使pH值进一步降低,所以在配制固体培养基时,pH值调节一般要比液体培养基的pH值稍高一些。
2.3.2.3 固体培养基灭菌
固体培养基的灭菌方法与液体培养基的灭菌方法总体上相同,但也有其独特之处。固体培养基是在液体培养基的基础上添加凝固剂凝固而成的,最常用的凝固剂为琼脂。由于琼脂在酸性环境中容易被水解,特别是高温情况下更容易被水解,而生物去除加工所用的培养基一般为酸性,同时因琼脂水溶液黏度太高,采用微孔过滤会堵塞微孔,从而无法通过微孔滤膜过滤除菌,所以通常在配制固体培养基时,先将琼脂分开并单独进行高温高压灭菌,再将其混合冷却凝固制成平板。无机盐与能源物质的灭菌方法与液体培养基的灭菌方法基本相同。
2.3.2.4 固体培养基种类
对于氧化亚铁硫杆菌和氧化硫硫杆菌等这类化能自养细菌,目前主要分为单层固体培养基和双层固体培养基。
(1)单层固体培养基。单层固体培养基没有分层,由一种混合物加热成液态后倾倒入培养皿冷却凝固而成,如庄贺等[47]制作的9K单层固体平板培养基,步骤如下:①将3.0 g (NH4)2SO4、0.5 g K2HPO4、0.1 g KCl,0.5 g MgSO4·7H2O、0.01 g Ca(NO3)2溶于1 L蒸馏水中得到A液,然后用体积比为6 mol/L的H2SO4溶液调节A液的pH值至2.8,并在1×105 Pa高压条件下灭菌20 min;②将24 g FeSO4·7H2O溶于180 mL蒸馏水中得到B液,并采用过滤方法对B液进行除菌;③将15.0 g琼脂溶于400 mL蒸馏水中得到C液,并在1×105 Pa高压条件下灭菌20 min;④从A液中取出420 mL,并与B液及C液混合。
(2)双层固体培养基。双层固体培养是在单层固体培养基的基础上发展而来的,主要是为了解决单层固体培养基在培养氧化亚铁硫杆菌等这类化能自养细菌的过程中所遇到的问题,如琼脂等有机凝固剂在酸性环境下,水解产生对氧化亚铁硫杆菌等细菌的生长有强烈抵制作用的有机物[48],使得所培养出的菌落数比实际接种的单个活菌数少很多。双层固体培养基,顾名思义是由两层不同的固体培养基组成的。具体操作为在接种了某种异养微生物的单层培养基表面,继续倒入一层液态的9K培养基或Leathen培养基凝固而成。由于中间生长的异养微生物能够消耗有机物,因此可以将对氧化亚铁硫杆菌等细菌的生长有强烈抵制作用的有机物消耗掉,从而增加固体培养基的菌落形成数。此外,异养微生物的生长速度非常快,生长过程中可以释放出大量的CO2,可为氧化亚铁硫杆菌等细菌的生长提供碳源,进一步促进其生长繁殖[49]。王世梅等[48]制作了双层固体平板培养基,具体操作如下:①在无菌平板培养皿中倒入已溶化并冷却至60 ℃的水琼脂作为底层平板;②待平板凝固后,用无菌吸管取0.1 mL对数期的酵母菌R30菌液于底层平板并均匀涂布,放置1~2 h;③将前文所述的用于配制单层固态培养基的A、B、C液混合,冷却至50 ℃左右后迅速倒入已有的固体培养基上流动成平面,并作为上层平板,凝固后备用。
3 生物去除加工机理
生物去除加工在机理研究方面与生物冶金一样,都主要集中研究氧化亚铁硫杆菌的两种氧化机理:直接氧化和间接氧化[50]。对于生物去除加工,学者们还提出了单纯的间接氧化机理和间接与直接氧化二者共存的加工机理。
3.1 间接氧化机理
ZHANG等[17]最早提出了氧化亚铁硫杆菌的加工金属机理,是从间接氧化的角度进行阐述,如图1所示。
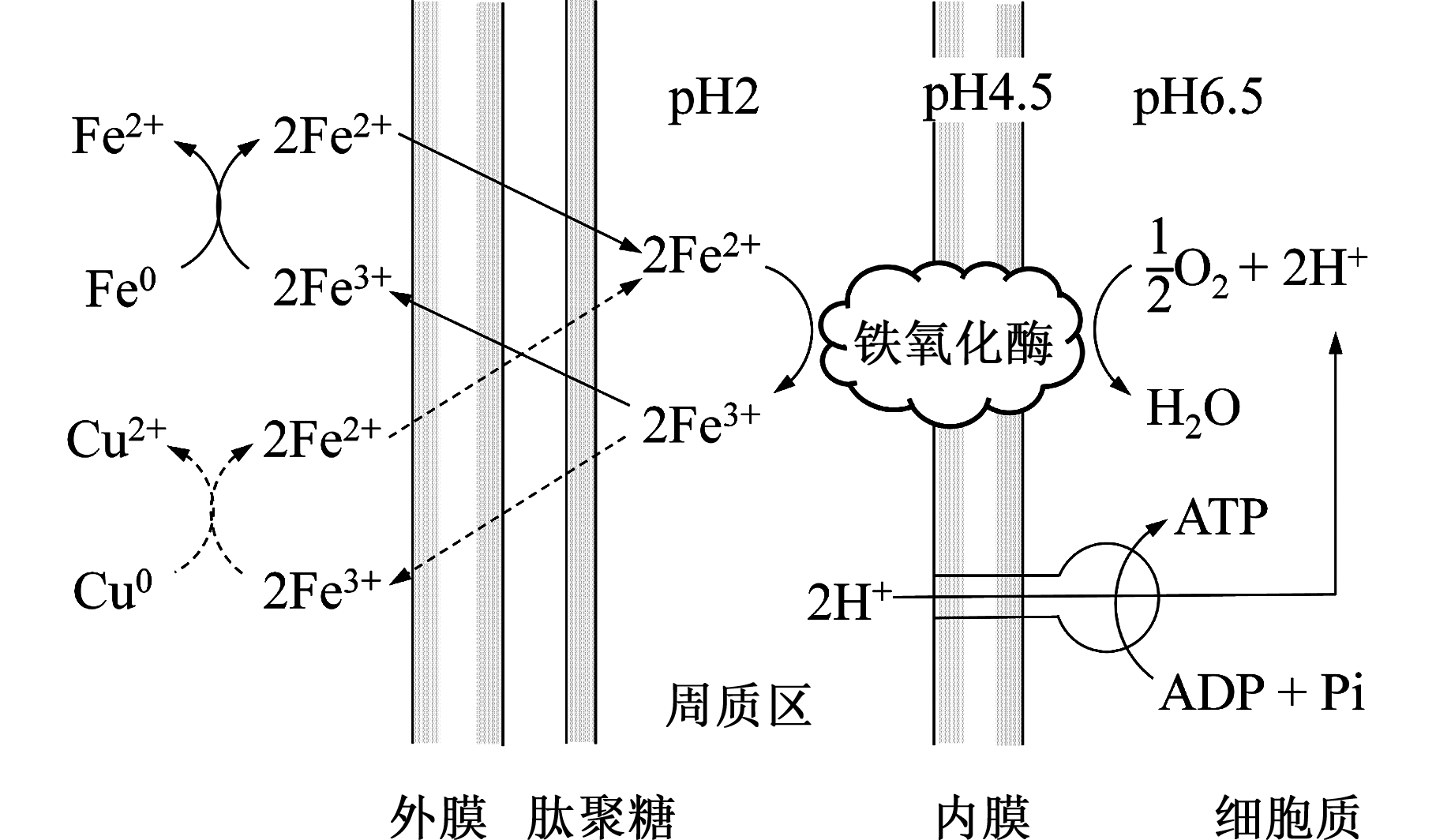
图1 氧化亚铁硫杆菌的生物去除加工机理
Fig.1 Biomachining mechanism of Acidithiobacillus ferrooxidans
由图1可以看出,氧化亚铁硫杆菌的细胞膜由外膜、肽聚糖、周质区和内膜构成,周质区和内膜内存在铁氧化酶,从培养液跨膜运送到细胞膜周质区的Fe2+在铁氧化酶的催化下失去一个电子生成Fe3+,这个电子经过一系列酶和蛋白质的传递作用,最终传递给电子受体氧分子,同时吸收细胞内的H+并释放能量。这一能量使细胞内的ADP转化成ATP,供细菌生长繁殖所用,而生成的Fe3+最终会通过生物膜排出体外。Fe3+是工业中常用的一种金属刻蚀剂,可以氧化去除Cu0和Fe0等金属,而自身被还原为Fe2+,之后又重新被细菌氧化为Fe3+,反复进行,形成一个循环往复的过程。其化学反应式如下:
M0+2Fe3+→M2++2Fe2+
其中,M代表Cu和Fe等。
HOCHENG等[34]利用去除细菌的培养上清液实现了纯铜等多种纯金属的去除加工,从而证明了在生物去除加工过程中存在间接氧化机理。
3.2 直接氧化机理
在上述氧化亚铁硫杆菌加工金属的机理中,细菌没有直接作用于金属,而是通过氧化Fe2+成为Fe3+,再由Fe3+氧化金属的间接氧化过程,所以上述机理被称为间接氧化机理。随着对氧化亚铁硫杆菌加工金属机理的进一步研究,直接氧化的机理被提出。研究发现,细菌可以通过胞外聚合物吸附的方式与工件材料直接接触,细菌代谢产生的酶通过胞外聚合物传递到工件表面,对金属材料直接进行氧化并实现去除。
LILOVA等[25]于2007年通过实验证明了在生物去除加工金属铜的过程中,不仅存在间接氧化机理,而且存在直接氧化机理。他们将氧化亚铁硫杆菌吸附并固定于平均粒径为28 μm的CuS颗粒上,再将这些颗粒固定于多孔的生物反应器中,持续通入无铁离子的9K液体培养基连续培养5天后,开始对纯铜进行加工。实验发现,溶液中的Cu2+浓度大幅升高,并在加工后的铜表面检测到了硫酸铜和绿铜钾石等物质的存在,进而证明了氧化亚铁硫杆菌在加工金属过程中存在直接氧化过程,但与间接氧化过程相比,直接氧化过程非常缓慢。XENOFONTOS等[6]通过对比含有细菌的培养液与去除细菌的培养上清液加工纯铜的去除率,量化了直接氧化机理和间接氧化机理在生物去除加工过程中的贡献比例,即前者仅占5%,而后者占95%。
4 材料去除率
4.1 单位时间内金属表面去除的深度
单位时间内加工金属表面的深度(μm/h)是早期衡量生物去除加工金属材料去除率的方式[1,17,22]。该衡量方法的优点是能与传统机械加工方式中的材料去除率进行对比,是一种非常直观的表示方式;缺点是测试比较困难,通常需要保留材料原来的表面高度,与加工表面之间形成落差,再通过各种方式进行测量,且对测试设备的精度要求较高。
4.2 材料去除率和比材料去除率
材料去除率RMR(material removal rate, MRR)和比材料去除率RSMR(specific material removal rate, SMRR)是CHANG等[35]于2008年最早提出和应用的两种衡量生物去除加工金属材料去除率的指标。
MRR(mg/(h·cm2))是单位时间和单位面积内的材料质量损失量,其表达式如下:
SMRR(mg/(h·(1×108/mL)·cm2))是单位时间、单位细菌浓度和单位面积内的材料质量损失量,其表达式如下:
式中,mtotal为去除总质量,mg;t为时间,h;A为面积,cm2;C为细菌浓度,108个/mL。
其中,SMRR指标考虑到了细菌浓度对MRR值的影响。
去除率指标的优点是测量方便,对设备要求较低,只需要电子天平就可以实施;缺点是不能直接与机械加工速度进行比较。
5 主要问题和展望
虽然生物去除加工技术在近几年发展较快,但至今仍未见到生物去除加工在工程上应用的相关报道,主要的原因有:①生物去除加工的机理尚未明确;②材料去除率总体上还不高,每小时去除深度只有13 μm左右[19-20];③生物去除加工的应用研究范围还不够广泛,仅集中在金属的表面刻蚀领域。针对目前生物去除加工存在的几方面问题,提出如下几点展望。
(1)生物去除加工机理方面应展开更深入的研究。只有在生物去除加工机理被彻底了解清楚的前提下,加工过程才能被更好地控制。特别是直接氧化机理方面还有很大的研究空间,如果能实现将直接氧化机理过程中起作用的酶进行提取和浓缩,生物去除加工的可控性和应用前景必将得到巨大提升。
(2)开展提高材料去除率的研究。提高材料去除率几乎是所有加工方法共同追求的目标,而对于生物去除加工则显得更加迫切。这也是学者们正在努力的方向,如UNO等[1,16]发现在生物去除加工过程中加入电场能提高材料去除率;ZHANG等[18]向加工液通入H2S气体后可将加工铜生成的大量Cu2+去除,以降低Cu2+对细菌生长的抑制作用,从而提高材料去除率。
(3)开拓生物去除加工的应用范围。在传统的化学加工过程中,氧化剂浓度随着反应消耗逐渐降低,进而导致加工速度减慢;而在生物去除加工的过程中,氧化亚铁硫杆菌可连续地将Fe2+转化为Fe3+,所以在不提高溶液总铁浓度的情况下,将Fe3+浓度维持在一定范围内,就能实现材料的匀速去除[1,17]。由此可知,生物去除加工在理论上能对金属材料进行各种形式的精密去除加工,而不局限于金属表面的刻蚀领域。
6 结论
(1)生物去除加工技术是在生物冶金技术的基础上发展起来的,起步比较晚,目前仍以基础研究为主,实际应用尚无报道。
(2)生物去除加工研究的材料包括纯金属和合金类材料,其中对纯铜的研究最多,菌种以氧化亚铁硫杆菌为主,培养基以9K培养基为主。
(3)生物去除加工过程公认以间接氧化机理为主,直接氧化机理也被证明与间接氧化机理同时存在,但直接氧化的速度相对慢很多。
(4)生物去除加工材料去除率的衡量方式包括单位时间内金属表面去除的深度、材料去除率指标和比材料去除率指标,各衡量方式各有优劣。
(5)更深入地研究去除机理、提高材料去除率、开拓应用范围将是生物去除加工技术的主要发展方向。
[1] UNO Y, KANEEDA T, YOKOMIZO S. Fundamental Study on Biomachining (Machining of Metals by Thiobacillus Ferrooxidans)[J]. JSME International Journal, Series C: Dynamics, Control, Robotics, Design and Manufacturing, 1996, 39(4): 837-842.
[2] DIAZ-TENA E, BARONA A, GALLASTEGUI G, et al. Biomachining: Metal Etching via Microorganisms[J]. Critical Reviews in Biotechnology, 2017, 37(3): 323-332.
[3] D AZ-TENA E, ROJO N, GURTUBAY L, et al. Biomachining: Preservation of Acidithiobacillus Ferrooxidans and Treatment of the Liquid Residue[J]. Engineering in Life Sciences, 2017, 17(4): 382-391.
AZ-TENA E, ROJO N, GURTUBAY L, et al. Biomachining: Preservation of Acidithiobacillus Ferrooxidans and Treatment of the Liquid Residue[J]. Engineering in Life Sciences, 2017, 17(4): 382-391.
[4] D AZ-TENA E, GALLASTEGUI G, HIPPERDINGER M, et al. New Advances in Copper Biomachining by Iron-oxidizing Bacteria[J]. Corrosion Science, 2016, 112: 385-392.
AZ-TENA E, GALLASTEGUI G, HIPPERDINGER M, et al. New Advances in Copper Biomachining by Iron-oxidizing Bacteria[J]. Corrosion Science, 2016, 112: 385-392.
[5] IMRAN M, SARAGIH A S, SAHAR M S U, et al. Digital Maskless Lithography Capabilities for Surface Texturing with Biomachining[J]. The International Journal of Advanced Manufacturing Technology, 2017, 89(9/12): 3709-3719.
[6] XENOFONTOS E, FEIDIOU A, CONSTANTINOU M, et al. Copper Biomachining Mechanisms Using the Newly Isolated Acidithiobacillus Ferrooxidans B1[J]. Corrosion Science, 2015, 100: 642-650.
[7] MUHAMMAD I, ULLAH S M S, HAN D S, et al. Selection of Optimum Process Parameters of Biomachining for Maximum Metal Removal Rate[J]. International Journal of Precision Engineering and Manufacturing—Green Technology, 2015, 2(4): 307-313.
[8] MUHAMMAD I, KO T J. Escalation of Metal Removal Rate of Biomachining by Controlling Various Process Parameters[J]. Korean Society of Precision Engineering, 2014, 10: 141-142.
[9] SUWANDI D, WHULANZA Y, ISTIYANTO J. Visible Light Maskless Photolithography for Biomachining Application[J]. Applied Mechanics and Materials, 2014, 493: 552-557.
[10] D AZ-TENA E, RODR
AZ-TENA E, RODR GUEZ-EZQUERRO A, MARCAIDE L N L D L, et al. A Sustainable Process for Material Removal on Pure Copper by Use of Extremophile Bacteria[J]. Journal of Cleaner Production, 2014, 84(1): 752-760.
GUEZ-EZQUERRO A, MARCAIDE L N L D L, et al. A Sustainable Process for Material Removal on Pure Copper by Use of Extremophile Bacteria[J]. Journal of Cleaner Production, 2014, 84(1): 752-760.
[11] OLSON G J, BRIERLEY J A, BRIERLEY C L. Bioleaching Review Part B: Progress in Bioleaching: Applications of Microbial Processes by the Minerals Industries[J]. Applied Microbiology and Biotechnology, 2003, 63(3): 249-257.
[12] COLMER A R, HINKLE M E. The Role of Microorganisms in Acid Mine Drainage: a Preliminary Report[J]. Science, 1947, 106(2751): 253-256.
[13] WAKSMAN S A, JOFFE J S. Microörganisms Concerned in the Oxidation of Sulfur in the Soil: Ⅱ. Thiobacillus Thiooxidans, a New Sulfur-oxidizing Organism Isolated from the Soil[J]. Journal of Bacteriology, 1922, 7(2): 239-256.
[14] BRYNER L C, JAMESON A K. Microorganisms in Leaching Sulfide Minerals[J]. Applied Microbiology, 1958, 6(4): 281-287.
[15] ZIMMERLEY S R, WILSON D G, PRATER J D. Cyclic Leaching Process Employing Iron Oxidizing Bacteria: US, 2829964[P]. 1958-04-08.
[16] UNO Y, KANEEDA T, YOKOMIZO S, et al. Fundamental Study on Electric Field Assisted Biomachining[J]. Seimitsu Kogaku Kaishi/Journal of the Japan Society for Precision Engineering, 1996, 62(4): 540-543.
[17] ZHANG D Y, LI Y Q. Possibility of Biological Micromachining Used for Metal Removal[J]. Science in China(Series C: Life Sciences), 1998, 41(2): 151-156.
[18] ZHANG D Y, LI Y Q. Studies on Kinetics and Thermodynamics of Biomachining Pure Copper[J]. Science in China(Series C: Life Sciences), 1999, 42(1): 57-62.
[19] YANG Y, WANG X B, LIU Y D, et al. Techniques for Micromachining Using Thiobacillus Ferrooxidans Based on Different Culture Medium[J]. Applied Mechanics and Materials, 2009, 16/19: 1053-1057.
[20] HOCHENG H, CHANG J, JADHAV U U. Micromachining of Various Metals by Using Acidithiobacillus Ferrooxidans 13820 Culture Supernatant Experiments[J]. Journal of Cleaner Production, 2012, 20(1): 180-185.
[21] KUMADA M, KAWAKADO T, KOBUCHI S, et al. Investigations of Fine Biomachining of Metals by Using Microbially Influenced Corrosion—Differences between Steel and Copper in Metal Biomachining by Using Thiobacillus Ferrooxidans[J]. Zairyo to Kankyo/Corrosion Engineering, 2001, 50(9): 411-417.
[22] OKADA A, UNO Y, HISANO T, et al. Study on Material Removal Mechanism and Improvement of Machining Speed in Biomachining[J]. Seimitsu Kogaku Kaishi/Journal of the Japan Society for Precision Engineering, 2002, 68(12): 1585-1589.
[23] 刘玉德,王西彬,蒋放,等. 基于生物刻蚀原理制作微小齿轮结构[J]. 北京工商大学学报(自然科学版), 2005, 23(5): 21-23.
LIU Yude, WANG Xibin, JIANG Fang, et al. Micro Gear Structure Fabricated Based on Principle of Biological Etch[J]. Journal of Beijing Technology and Business University (Natural Science Edition), 2005, 23(5): 21-23.
[24] JOHNSON D, WARNER R, SHIH A J. Surface Roughness and Material Removal Rate in Machining Using Microorganisms[J]. Journal of Manufacturing Science and Engineering, 2007, 129(1): 223-227.
[25] LILOVA K, KARAMANEV D, FLEMMING R L, et al. Biological Oxidation of Metallic Copper by Acidithiobacillus Ferrooxidans[J]. Biotechnology and Bioengineering, 2007, 97(2): 308-316.
[26] ISTIYANTO J, KO T J, YOON I. A Study on Copper Micromachining Using Microorganisms[J]. International Journal of Precision Engineering and Manufacturing, 2010, 11(5): 659-664.
[27] ISTIYANTO J, KIM M Y, KO T J. Profile Characteristics of Biomachined Copper[J]. Microelectronic Engineering, 2011, 88(8): 2614-2617.
[28] JADHAV U U, HOCHENG H, WENG W. Innovative Use of Biologically Produced Ferric Sulfate for Machining of Copper Metal and Study of Specific Metal Removal Rate and Surface Roughness during the Process[J]. Journal of Materials Processing Technology, 2013, 213(9): 1509-1515.
[29] ISTIYANTO J, SARAGIH A, KO T J. Metal Based Micro-feature Fabrication Using Biomachining Process[J]. Microelectronic Engineering, 2012, 98: 561-565.
[30] JADHAV U, HOCHENG H. Use of Aspergillus Niger 34770 Culture Supernatant for Tin Metal Removal[J]. Corrosion Science, 2014, 82: 248-254.
[31] ISTIYANTO J, TAUFIQURRAKHMAN M, KISWANTO G, et al. Inclination Angle Effect on Surface of Copper in Biomachining[J]. Applied Mechanics and Materials, 2014, 660: 23-27.
[32] D AZ-TENA E, RODR
AZ-TENA E, RODR GUEZ-EZQUERRO A, MARCAIDE L N L D L, et al. Use of Extremophiles Microorganisms for Metal Removal[J]. Procedia Engineering, 2013, 63: 67-74.
GUEZ-EZQUERRO A, MARCAIDE L N L D L, et al. Use of Extremophiles Microorganisms for Metal Removal[J]. Procedia Engineering, 2013, 63: 67-74.
[33] LIU Y D, WANG X B, YANG Y, et al. Processing Micro-gear Based on Bio-etching Method[J]. Applied Mechanics and Materials, 2009, 16/19: 120-123.
[34] HOCHENG H, CHANG J H, HSU H S, et al. Metal Removal by Acidithiobacillus Ferrooxidans through Cells and Extra-cellular Culture Supernatant in Biomachining[J]. CIRP Journal of Manufacturing Science and Technology, 2012, 5(2): 137-141.
[35] CHANG J H, HOCHENG H, CHANG H Y, et al. Metal Removal Rate of Thiobacillus Thiooxidans without Pre-secreted Metabolite[J]. Journal of Materials Processing Technology, 2008, 201(1/3): 560-564.
[36] HOCHENG H, JADHAV U U, CHANG J H. Biomachining Rates of Various Metals by Acidithiobacillus Thiooxidans[J]. International Journal of Surface Science and Engineering, 2012, 6(1/2): 101-111.
[37] TING Y P, KUMAR A S, RAHMAN M, et al. Innovative Use of Thiobacillus Ferrooxidans for the Biological Machining of Metals[J]. Acta Biotechnologica, 2000, 20(20): 87-96.
[38] MIYANO Y, KAMIYA O, LOTFI C, et al. Fundamental Studies on Biomachining of Carbon Steel by Iron Oxidizing Bacteria[J]. Transactions of JWRI, 2003, 32(1): 239-242.
[39] MIYANO Y, TSUBONUMA T, SREEKMARI K R, et al. Biomachining of Stainless Steel Using Bacteria[D]. Osaka: Osaka University, 2003, 32(1): 183-187.
[40] 刘玉德,王西彬,石文天,等. 氧化硫硫杆菌和氧化亚铁硫杆菌生物刻蚀加工的协同作用[J]. 北京理工大学学报, 2010, 30(9): 1028-1031.
LIU Yude, WANG Xibin, SHI Wentian, et al. Synergism Effect of Thiobacillus Thiooxidans and Thiobacillus Ferrooxidans on the Bio-etching[J]. Transactions of Beijing Institute of Technology, 2010, 30(9): 1028-1031.
[41] 李松梅,王彦卿,刘建华,等. 氧化亚铁硫杆菌和氧化硫硫杆菌的协同作用对Q235钢腐蚀行为的影响[J]. 中国腐蚀与防护学报, 2009, 29(3): 182-186.
LI Songmei, WANG Yanqing, LIU Jianhua, et al. Synergism Effect of Thiobacillus Ferrooxidans and Thiobacillus Thiooxidan on the Corrosion Behavior of Steel Q235[J]. Journal of Chinese Society for Corrosion and Protection, 2009, 29(3): 182-186.
[42] XIN B, ZHANG D, ZHANG X, et al. Bioleaching Mechanism of Co and Li from Spent Lithium-ion Battery by the Mixed Culture of Acidophilic Sulfur-oxidizing and Iron-oxidizing Bacteria[J]. Bioresource Technology, 2009, 100(24): 6163-6169.
[43] LIANG G, MO Y, ZHOU Q. Novel Strategies of Bioleaching Metals from Printed Circuit Boards(PCBs) in Mixed Cultivation of Two Acidophiles[J]. Enzyme and Microbial Technology, 2010, 47(7): 322-326.
[44] WANG J, BAI J, XU J, et al. Bioleaching of Metals from Printed Wire Boards by Acidithiobacillus Ferrooxidans and Acidithiobacillus Thiooxidans and Their Mixture[J]. Journal of Hazardous Materials, 2009, 172(2/3): 1100-1105.
[45] SILVERMAN M P, LUNDGREN D G. Studies on the Chemoautotrophic Iron Bacterium Ferrobacillus Ferrooxidans Ⅱ: Manometric Studies[J]. Journal of Bacteriology, 1959, 78(3): 326-331.
[46] LEATHEN W W, BRALEY S A. A Medium for the Study of the Bacterial Oxidation of Ferrous Iron[J]. Science, 1951, 114(2959): 280-281.
[47] 庄贺,沈俊剑,黎俊,等. 氧化亚铁硫杆菌的分离鉴定及培养条件优化[J]. 微生物学通报, 2013, 40(7): 1131-1137.
ZHUANG He, SHEN Junjian, LI Jun, et al. Isolation and Identification of Thiobacillus Ferrooxidans Isolation and Identification of Thiobacillus Ferrooxidans and Optimization of Its Culture Condition[J]. Microbiology China, 2013,40(7): 1131-1137.
[48] 王世梅,周立祥. 提高氧化亚铁硫杆菌和氧化硫硫杆菌平板检出率的方法:双层平板法[J]. 环境科学学报, 2005, 25(10): 1418-1420.
WANG Shimei, ZHOU Lixiang. A Renovated Approach for Increasing Colony Count Efficiency of Thiobacillus Ferrooxidans and Thiobacillus Thiooxidans: Double-layer Plates[J]. Acta Scientiae Circumstantiae, 2005, 25(10): 1418-1420.
[49] 冯守帅,杨海麟,高凯,等. 极端嗜酸硫杆菌高效筛选、高密度发酵及保藏方法的研究[J]. 微生物学通报, 2014, 41(12): 2565-2573.
FENG Shoushuai, YANG Hailin, GAO Kai, et al. The Study on Efficient Screening, High-density Fermentation and Preservation Methods for Extremely Acidithiobacillus Sp.[J]. Microbiology China, 2014, 41(12): 2565-2573.
[50] SAND W, GEHRKE T, JOZSA P, et al. (Bio)Chemistry of Bacterial Leaching—Direct vs. Indirect Bioleaching[J]. Hydrometallurgy, 2001, 59(2/3): 159-175.
